沙美特罗替卡松粉吸入剂:舒利迭以联合用药形式,用于可逆性阻塞性气道疾病的常规治疗,包括成人和儿童哮喘。 孟鲁司特钠片:本品适用于15岁及15岁以上成人哮喘的预防和长期治疗,包括预防白天和夜间的哮喘症状,治疗对阿司匹林敏感的哮喘患者以及预防运动诱发的支气管收缩。 本品适用于减轻过敏性鼻炎引起的症状(15岁及15岁以上成人的季节性过敏性鼻炎和常年性过敏性鼻炎)。
健客价: ¥462用于1岁以上儿童哮喘的预防和长期治疗,包括预防白天和夜间的哮喘症状,治疗对阿斯匹林敏感的哮喘患者以及预防运动诱发的支气管收缩。 顺尔宁适用于2岁至5岁儿童以减轻季节性过敏性鼻炎引起的症状。
健客价: ¥56本品适用于15岁及15岁以上成人哮喘的预防和长期治疗,包括预防白天和夜间的哮喘症状,治疗对阿司匹林敏感的哮喘患者以及预防运动诱发的支气管收缩。 本品适用于减轻过敏性鼻炎引起的症状(15岁及15岁以上成人的季节性过敏性鼻炎和常年性过敏性鼻炎)。
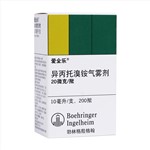
健客价: ¥36.5爱全乐可与吸入性β受体激动剂合用与治疗急性或慢性哮喘引起的可逆性气道阻塞。
健客价: ¥40爱全乐作为支气管扩张剂用于慢性阻塞性肺部疾病引起的支气管痉挛维持治疗,包括慢性支气管炎和肺气肿。爱全乐可与吸入性β受体激动剂合用于治疗慢性阻塞性肺部疾病包括慢性支气管炎和哮喘引起的急性支气管痉挛。
健客价: ¥49本品适用于预防和治疗与慢性阻塞性气道疾病相关的呼吸困难;慢性阻塞性支气管炎伴或不伴有肺气肿;轻到中度支气管哮喘。
健客价: ¥50舒利迭以联合用药形式(支气管扩张剂和吸入皮质激素),用于可逆性阻塞性气道疾病的常规治疗,包括成人和儿童哮喘。这可包括:1.接受有效维持剂量的长效β2-激动剂和吸入型皮激素治疗的患者等。
健客价: ¥336本品适用于对传统治疗方法无效的慢性支气管痉挛的治疗及严重的急性哮喘发作的治疗。
健客价: ¥30本品适用于儿童哮喘的预防和长期治疗,包括预防白天和夜间的哮喘症状,治疗对阿司匹林敏感的哮喘患者以及预防运动引起的支气管收缩。本品适用于减轻过敏性鼻炎引起的症状。
健客价: ¥38舒利迭以联合用药形式,用于可逆性阻塞性气道疾病的常规治疗,包括成人和儿童哮喘。这可包括: 接受有效维持剂量的长效β受体激动剂和吸入性皮质激素治疗的患者。 目前使用吸入性皮质激素治疗但仍有症状的患者。 接受支气管扩张剂规则治疗但仍然需要吸入性皮质激素的患者。 注:本品对50μg/100μg规格不适用于患有重度哮喘的成人和儿童患者。
健客价: ¥209舒利迭以联合用药形式(支气管扩张剂和吸入皮质激素),用于可逆性阻塞性气道疾病的常规治疗,包括成人和儿童哮喘。这可包括:1.接受有效维持剂量的长效β2-激动剂和吸入型皮激素治疗的患者。2.目前使用吸入型皮质激素治疗但仍有症状的患者。3.接受支气管扩张剂常规治疗但仍然需要吸入型皮质激素的患者。
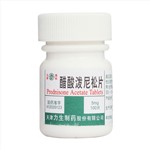
健客价: ¥144主要用于过敏性与自身免疫性炎症性疾病。适用于结缔组织病,系统性红斑狼疮,重症多肌炎,严重的支气管哮喘,皮肌炎,血管炎等过敏性疾病,急性白血病,恶性淋巴瘤。
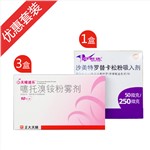
健客价: ¥7.5沙美特罗替卡松粉吸入剂:舒利迭以联合用药形式,用于可逆性阻塞性气道疾病的常规治疗,包括成人和儿童哮喘。 噻托溴铵粉雾剂:适用于慢性阻塞性肺病(COPD)的维持治疗,包括慢性支气管炎和肺气肿,伴随性呼吸困难的维持治疗及急性发作的预防。
健客价: ¥458适应于腰痛、颈肩腕综合征、肩周炎和变形性关节炎。
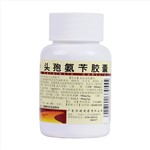
健客价: ¥169适用于敏感菌所致的急性扁桃体炎、咽峡炎、中耳炎、鼻窦炎、支气管炎、肺炎等呼吸道感染、尿路感染及皮肤软组织感染等。本品为口服制剂,不宜用于重症感染。
健客价: ¥13适用于敏感菌所致的急性扁桃体炎、咽峡炎、中耳炎、鼻窦炎、支气管炎、肺炎等呼吸道感染、尿路感染及皮肤软组织感染等。本品为口服制剂,不宜用于重症感染。
健客价: ¥9适用于敏感菌所致的急性扁桃体炎、咽峡炎、中耳炎、鼻窦炎、支气管炎、肺炎等呼吸道感染、尿路感染及皮肤软组织感染等。本品为口服制剂,不宜用于重症感染。
健客价: ¥15主要用于过敏性与自身免疫性炎症性疾病。适用于结缔组织病,系统性红斑狼疮,重症多肌炎,严重的支气管哮喘,皮肌炎,血管炎等过敏性疾病,急性白血病,恶性淋巴瘤以及适用于其他肾上腺皮质激素类药物的病症等。
健客价: ¥7.9适用于敏感细菌所致的尿路感染,皮肤软组织感染以及急性扁桃体炎、急性咽炎、中耳炎和肺部感染等。本品为口服制剂,不宜用于重症感染。
健客价: ¥9沙美特罗替卡松粉吸入剂(舒利迭):舒利迭以联合用药形式,用于可逆性阻塞性气道疾病的常规治疗,包括成人和儿童哮喘。 荷氏B族维生素片:补充多种B族维生素。
健客价: ¥361主要用于过敏性与自身免疫性炎症性疾病。适用于结缔组织病,系统性红斑狼疮,重症多肌炎,严重的支气管哮喘,皮肌炎,血管炎等过敏性疾病,急性白血病,恶性淋巴瘤。
健客价: ¥6.2主要用于过敏性与自身免疫性炎症性疾病。适用于结缔组织病,系统性红斑狼疮,重症多肌炎,严重的支气管哮喘,皮肌炎,血管炎等过敏性疾病,急性白血病,恶性淋巴瘤。
健客价: ¥6.5适用于敏感菌所致的急性扁桃体炎、咽峡炎、中耳炎、鼻窦炎、支气管炎、肺炎等呼吸道感染、尿路感染及皮肤软组织感染等。本品为口服制剂,不宜用于重症感染。
健客价: ¥6适用于敏感菌所致的急性扁桃体炎、咽峡炎、中耳炎、鼻窦炎、支气管炎、肺炎等呼吸道感染、尿路感染及皮肤软组织感染等。本品为口服制剂,不宜用于重症感染。
健客价: ¥12